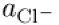Die Kalomelelektrode (GKE, engl.: Saturated Calomel Electrode, SCE) ist eine Elektrode zweiter Art.
Aufbau
Eine Kalomelelektrode besteht aus Quecksilber, welches mit schwerlöslichem Kalomel (Hg2Cl2) überzogen ist und in eine gesättigte Kaliumchlorid-Lösung taucht. Mit der Analysenlösung kann Kontakt über ein Diaphragma (semipermeable Membran) oder einen Flüssigkeitsfilm im Schliffstopfen hergestellt werden.
Die Zellnotation der gesättigten Kalomelelektrode lautet:
Funktionsprinzip
Die potentialbestimmende Elektrodenreaktion ist das Gleichgewicht zwischen Metall in der Elektrode und Metallionen in der KCl-Lösung:
Das Potential der Elektrode, E, wird durch die Nernst-Gleichung beschrieben, wobei E° das Standardpotential der Elektrodenreaktion, R die allgemeine Gaskonstante, T die thermodynamische Temperatur und F die Faraday-Konstante ist:
Für das Löslichkeitsgleichgewicht gilt:
Das Löslichkeitsprodukt, KL, ist damit folglich:
Die Gleichung des Löslichkeitsprodukts kann für die Quecksilberkonzentration eingesetzt werden, um das Potential allein in Abhängigkeit von der Chloridkonzentration zu erhalten:
Der KL-Term ist wie das Standardpotential lediglich von der Temperatur abhängig. Es ist also sinnvoll, ihn in ein neu definiertes Standardpotential, das der Kalomelelektrode, einzubeziehen:
Literatur
- Matthias Otto: Analytische Chemie. 3., vollständig überarbeitete und erweiterte Auflage. Wiley-VCH, Weinheim 2006, ISBN 3-527-31416-4, S. 366.